Proceso Isobárico y su Relación con las Máquinas Térmicas
Varios procesos termodinámicos describen cómo los estados de un gas ideal pueden sufrir cambios. El proceso isobárico es solo uno de ellos. Un proceso isobárico es un proceso termodinámico que se produce a presión constante. En este ámbito, se aplica la Ley de Charles ya que la presión se mantiene constante.
Los tipos de procesos que pueden ocurrir cuando la presión se mantiene constante incluyen la expansión isobárica, en la que el volumen aumenta mientras la temperatura disminuye, y la contracción isobárica, en la que el volumen disminuye mientras la temperatura aumenta.
Si alguna vez has cocinado una comida en el microondas que requiere que cortes un orificio de ventilación en el plástico antes de ponerla en el microondas, esto se debe a la expansión isobárica.
Dentro del microondas, la presión dentro y fuera de la bandeja de comida cubierta de plástico es siempre la misma y siempre en equilibrio. Pero a medida que la comida se cocina y se calienta, el aire dentro de la bandeja se expande como resultado del aumento de temperatura.
Si no hay ventilación disponible, el plástico podría expandirse hasta el punto en que explote.
- ¿Qué es un Proceso Isobárico?
- Procesos isobáricos y la Primera Ley de la Termodinámica
- Procesos isobáricos en motores térmicos
- Máquinas Térmicas
- ¿Cómo funcionan las máquinas térmicas?
- Rendimiento de máquinas térmicas
- Ciclo de Otto
- ¿Qué es el estudio de la termodinámica?
- Ley de Charles y la ley de los gases ideales
- Teoría cinética y variables de estado
¿Qué es un Proceso Isobárico?
En la transformación isobárica de gases, la presión permanece constante y el volumen aumenta o disminuye en proporción a la variación de temperatura. Se produce una transformación isobárica cuando el gas está a presión constante. Por ejemplo, si se hace en un ambiente abierto, la transformación será isobárica, ya que la presión será la presión atmosférica que no cambiará.
En ese caso, la temperatura y el volumen varían. Dos científicos destacados han estudiado cómo se produce esta variación en las transformaciones isobáricas. El primero en relacionar el volumen y la temperatura de los gases fue Jacques Charles (1746-1823), en 1787, y luego, en 1802, Joseph Gay-Lussac (1778-1850) cuantificó esta relación.
Así, surgió una ley que explica las transformaciones isobáricas de los gases, que se conoció como Ley de Charles / Gay-Lussac. Se explica de la siguiente manera:
"En un sistema con presión constante, el volumen de una masa fija de un gas es directamente proporcional a la temperatura".
Charles y Gay-Lussac estudiaron las transformaciones isobáricas. Esto significa que si duplicamos la temperatura, el volumen que ocupa el gas también se duplicará. Por otro lado, si bajamos la temperatura, el volumen del gas también disminuirá en la misma proporción.
Esto se puede ver en un experimento muy simple. Si colocamos un globo en el cuello de una botella, quedará atrapada una determinada masa fija de aire. Si sumerges esta botella en un recipiente con agua fría, el globo se arrugará. Ahora, si lo ponemos en un bol con agua caliente, el globo se llenará.
Esto se debe a que cuando aumenta la temperatura, aumenta la energía cinética de las moléculas de gas y también aumenta la velocidad con la que se mueven. Así, el gas se expande, aumentando el volumen que ocupa, y el globo se infla. Lo contrario ocurre cuando bajamos la temperatura colocándola en agua helada.
Esta relación entre temperatura y volumen en las transformaciones isobáricas viene dada por la siguiente relación:
V / T = K
Donde:
- V = Volumen.
- T = Temperatura.
- K = Constante.
Así, podemos establecer la siguiente relación para las transformaciones isobáricas:
(Vi / Ti) = (Vf / Tf)
Donde:
- Vi = Volumen inicial.
- Ti = Temperatura inicial.
- Vf = Volumen final.
- Tf = Temperatura final.
Esto significa que cuando hay un cambio en la temperatura del gas a presión constante, podremos descubrir su volumen a través de esta expresión matemática. Lo contrario también es cierto, conociendo el volumen del gas, averiguamos a qué temperatura se encuentra.
Para un rápido experimento de compresión isobárica en casa, coloca un globo inflado en tu congelador. Nuevamente, la presión dentro y fuera del globo siempre estará en equilibrio. Pero a medida que el aire del globo se enfría, se encogerá.
Si cualquier recipiente en el que se encuentre el gas puede expandirse y contraerse libremente, y la presión externa permanece constante, entonces cualquier proceso será isobárico porque cualquier diferencia en las presiones causaría expansión o contracción hasta que esa diferencia se resuelva.
También te puede interesar Rectificación De Motores, Importancia Y Procesos
Procesos isobáricos y la Primera Ley de la Termodinámica
La primera ley de la termodinámica establece que el cambio de energía interna U de un sistema es igual a la diferencia entre la cantidad de energía térmica Q añadida al sistema, y el trabajo neto W realizado por el sistema. En forma de ecuación, esto es:
ΔU = Q-W
Recuerda que la temperatura era la energía cinética promedio por molécula. La energía interna total es entonces la suma de las energías cinéticas de todas las moléculas.
Por lo tanto, la energía interna del sistema es directamente proporcional a la temperatura. Como la ley de los gases ideales relaciona la presión y el volumen con la temperatura, la energía interna también es proporcional al producto de la presión y el volumen.
Entonces, si se agrega energía térmica al sistema, la temperatura aumenta al igual que la energía interna. Si el sistema funciona en el medio ambiente, esa cantidad de energía se pierde en el medio ambiente y la temperatura y la energía interna disminuyen.
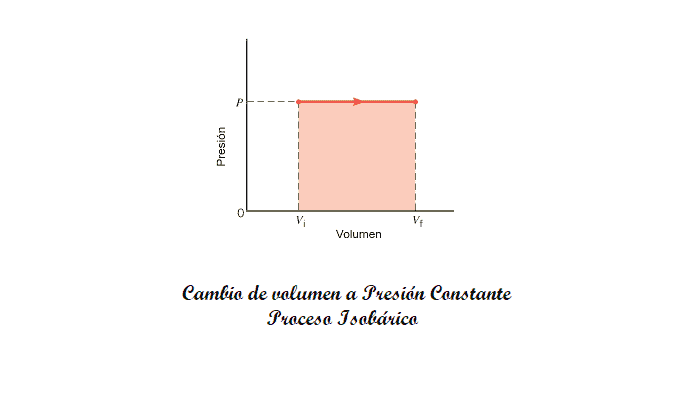
En un diagrama PV (gráfico de presión frente a volumen), un proceso isobárico se ve como un gráfico de una constante (Una gráfica horizontal). Dado que la cantidad de trabajo realizado durante un proceso termodinámico es igual al área bajo la curva PV, el trabajo realizado en un proceso isobárico es simplemente:
W=P .Δ V
Procesos isobáricos en motores térmicos
Los motores térmicos convierten la energía térmica en energía mecánica mediante un ciclo completo de algún tipo. Por lo general, esto requiere que un sistema se expanda en algún momento durante el ciclo para hacer trabajo e impartir energía a algo externo.
Considera un ejemplo en el que un matraz Erlenmeyer se conecta mediante un tubo de plástico a una jeringa de vidrio. Confinado dentro de este sistema hay una cantidad fija de aire.
Si el émbolo de la jeringa se puede deslizar libremente, actuando como un pistón móvil, al colocar el matraz en un baño de calor, como una tina de agua caliente, el aire se expandirá y levantará el émbolo, haciendo su trabajo.
Para completar el ciclo de dicha máquina térmica, el matraz debería colocarse en un baño frío para que la jeringa pueda volver a su estado inicial nuevamente. Puedes agregar un paso adicional de usar el émbolo para levantar una masa o hacer alguna otra forma de trabajo mecánico a medida que se mueve.
Varios procesos termodinámicos idealizados describen cómo los estados de un gas ideal pueden sufrir cambios. El proceso isobárico es solo uno de ellos.
Máquinas Térmicas
Las máquinas térmicas son dispositivos capaces de transformar la energía térmica en trabajo mecánico. Toda máquina térmica necesita una fuente de calor y una sustancia de trabajo capaz de modificar su volumen y, en consecuencia, mover algún mecanismo, como válvulas o pistones.
Los motores de combustión interna, como los que impulsan el automóvil actual, son grandes ejemplos de motores térmicos. Absorben el calor que se produce al quemar una mezcla de combustible y aire, que periódicamente se inyecta en sus cilindros, y lo convierten en movimiento.
De esta manera, parte de la energía que se libera durante la explosión se convierte en trabajo, mediante el movimiento del pistón, una de las partes móviles del motor, que se utiliza para convertir la energía térmica en energía cinética.
¿Cómo funcionan las máquinas térmicas?
Todas las máquinas térmicas funcionan según un ciclo termodinámico, es decir, secuencias de estados y procesos termodinámicos que se repiten. Estos ciclos tienen diferentes estados de volumen, presión y temperatura, que generalmente se representan mediante gráficos de presión en función del volumen.
Los ciclos termodinámicos se diseñan en busca de una mayor eficiencia energética, es decir, siempre se busca la producción de motores capaces de extraer una gran cantidad de trabajo.
En cualquier ciclo termodinámico, es posible calcular el trabajo de forma gráfica. Por lo tanto, es necesario calcular el área dentro del gráfico, lo que puede resultar complicado de hacer, si el ciclo en cuestión tiene una forma irregular.
Además, la dirección de las flechas, en sentido horario o antihorario, indica si el ciclo en cuestión es el ciclo de una máquina térmica o un frigorífico:
- Ciclo en el sentido de las agujas del reloj: Si el ciclo es en el sentido de las agujas del reloj, el ciclo es el de una máquina térmica, que absorbe calor y produce trabajo.
- Ciclo en el sentido antihorario: En el caso de que la dirección de un ciclo sea en sentido antihorario, necesita recibir trabajo mecánico y liberar calor, como en el caso de los motores de los refrigeradores.
Cualquier motor térmico tiene una configuración similar, proporciona una fuente de calor, que extrae la energía necesaria para su funcionamiento, y un sumidero, donde se disipa una parte del calor absorbido.
Según la primera ley de la termodinámica, las máquinas térmicas necesitan recibir una cierta cantidad de calor para funcionar. Sin embargo, solo una pequeña fracción de esa cantidad de calor, que es una forma de energía, puede convertirse en trabajo útil.
Las razones de esta limitación son esencialmente dos: la primera se refiere a la capacidad técnica para producir una máquina que no disipa energía, lo cual es imposible. Y la segunda es una limitación de su propia naturaleza: según la 2a ley de la termodinámica, no hay máquina térmica que pueda presentar un rendimiento del 100%.
Ve lo que dice la segunda ley de la termodinámica, conocida como la ley de la entropía, según la declaración de Kelvin:
“No es posible que ningún sistema, a una determinada temperatura, absorba calor de una fuente y lo transforme por completo en trabajo mecánico, sin modificaciones en ese sistema o su entorno”.
La declaración de Kelvin se refiere a la conversión integral de calor en trabajo mecánico, afirmando que esto es imposible sin “cambios” en el sistema. Este cambio se refiere al efecto de la entropía, al eliminar el calor de alguna fuente caliente, parte de esa energía se descompone en formas de energía menos útiles.
Los procesos de degradación energética son muchos: vibración de las piezas mecánicas, fricción entre piezas y cojinetes, calor disipado al ambiente externo, producción de ruidos sonoros, etc.
Rendimiento de máquinas térmicas
El rendimiento de cualquier máquina térmica se puede calcular como la relación entre el trabajo mecánico que produce y la cantidad de calor que absorbe de alguna fuente caliente:
N = T/Qq
Donde:
- N = Rendimiento.
- T = Trabajo mecánico.
- Qq = Calor de la fuente.
El trabajo mecánico, a su vez, está determinado por la diferencia entre las cantidades de calor "caliente" y "frío", por lo que podemos escribir el rendimiento de las máquinas térmicas mediante estas cantidades:
N = 1 – Qf/Qq
Donde:
- N =
- Qf = Calor transferido a la fuente fría.
- Qq = Calor de la fuente.
Buscando determinar cuáles serían las características del ciclo termodinámico “perfecto”, el físico francés Sadi Carnot desarrolló un ciclo que, al menos teóricamente, presenta la mayor eficiencia posible para una máquina térmica que opera a las mismas temperaturas.
Este ciclo, conocido como ciclo de Carnot, popularmente llamado máquina de Carnot, no es una máquina real, ya que aún hoy, imposibilidades técnicas y prácticas han impedido la construcción de tal máquina.
Ciclo de Otto
El ciclo de Otto es una secuencia de cambios físicos que sufre alguna sustancia de trabajo como la gasolina o el etanol. Este ciclo se usa ampliamente en los motores de combustión interna que impulsan la mayoría de los vehículos de pasajeros.
Aunque no existe en la práctica, el ciclo de Otto fue diseñado para aproximarse a un ciclo de Carnot.
¿Qué es el estudio de la termodinámica?
La termodinámica es el estudio de los cambios que ocurren en los sistemas debido a la transferencia de energía térmica. Cada vez que dos sistemas de diferente temperatura están en contacto entre sí, la energía térmica se transferirá del sistema más caliente al sistema más frío.
Muchas variables diferentes afectan la forma en que ocurre esta transferencia de calor. Las propiedades moleculares de los materiales involucrados afectan la rapidez y facilidad con la que la energía térmica puede moverse de un sistema a otro, por ejemplo, y la capacidad calorífica específica afecta las temperaturas finales resultantes.
Cuando se trata de gases, ocurren muchos más fenómenos interesantes cuando se transfiere energía térmica. Los gases pueden expandirse y contraerse significativamente, y cómo lo hacen depende del contenedor en el que estén confinados, la presión del sistema y la temperatura.
Por lo tanto, comprender cómo funcionan los gases es importante para comprender la termodinámica.
Ley de Charles y la ley de los gases ideales
Un gas ideal es un gas en el que se hacen las siguientes suposiciones:
- Las moléculas pueden tratarse como partículas puntuales, sin ocupar espacio. Para que este sea el caso, no se permite alta presión, o las moléculas se acercarán lo suficiente como para que sus volúmenes se vuelvan relevantes.
- Las fuerzas e interacciones intermoleculares son insignificantes. La temperatura no puede ser demasiado baja para que este sea el caso. Cuando la temperatura es demasiado baja, las fuerzas intermoleculares comienzan a desempeñar un papel relativamente mayor.
- Las moléculas interactúan entre sí y con las paredes del contenedor en colisiones perfectamente elásticas. Esto permite asumir la conservación de la energía cinética.
Una vez que se hacen estas suposiciones, algunas relaciones se hacen evidentes. Entre estos se encuentra la ley de los gases ideales, que se expresa en forma de ecuación como:
PV = nRT = NkTPV =NkT
Donde:
- P es la presión.
- V es el volumen.
- T es la temperatura.
- n es el número de moles.
- N es el número de moléculas.
- R es la constante universal de los gases.
- k es la constante de Boltzmann.
- nR = Nk.
Estrechamente relacionada con la ley del gas ideal, está la Ley de Charles, que establece que, para la presión constante, el volumen y la temperatura son directamente proporcionales, o V / T = constante.
Teoría cinética y variables de estado
También te puede interesar Motor Fuera De Borda: Guía Completa
La teoría cinética proporciona una forma de modelar un gas para que se pueda aplicar la mecánica estadística, lo que eventualmente resulta en la posibilidad de definir un sistema a través de un conjunto de variables de estado.
Considera lo que es un gas: un grupo de moléculas capaces de moverse libremente entre sí. Para comprender un gas, tiene sentido observar sus componentes más básicos: las moléculas. Pero esto se vuelve engorroso muy rápidamente. Imagina la gran cantidad de moléculas en un vaso lleno de aire, por ejemplo.
No existe una computadora lo suficientemente poderosa para realizar un seguimiento de las interacciones de tantas partículas entre sí.
En cambio, al modelar el gas como una colección de partículas que experimentan un movimiento aleatorio, puedes comenzar a comprender la imagen general en términos de velocidades cuadráticas medias de las partículas, por ejemplo. Resulta conveniente empezar a hablar de la energía cinética media de las moléculas en lugar de identificar la energía asociada a cada partícula individual.
Estas cantidades conducen a la capacidad de definir variables de estado, que son cantidades que describen el estado de un sistema. Las principales variables de estado discutidas aquí serán la presión (la fuerza por unidad de área), el volumen (la cantidad de espacio que ocupa el gas) y la temperatura (que es una medida de la energía cinética promedio por molécula).
Al estudiar cómo estas variables de estado se relacionan entre sí, puedes comprender los procesos termodinámicos en una escala macroscópica.
Si quieres conocer otros artículos parecidos a Proceso Isobárico y su Relación con las Máquinas Térmicas puedes visitar la categoría Mecánica.
Deja una respuesta

¡Más Contenido!